
Sistemul materialelor didactice utilizate la lectia de chimie
Ca si celelalte discipline de studiu, chimia beneficiaza de aportul unei game largi de mijloace de invatamant pentru a usura procesul de invatare-predare. Aceasta usureaza nu numai achizitionarea cunostintelor (functia informatica) ci si formarea de abilitati si capacitati intelectuale (functia formativa).
Una din posibilitati de sistematizare a mijloacelor de invatamant, le clasifica in:
Dupa destinatia lor mijloacele de invatamant se impart in doua categorii:
Dupa functiile pedagogice dominante pe care le indeplinesc, materialele didactice se pot grupa:
I. Materiale informativ-demonstrative care includ:
- materiale intuitiv naturale: colectii de minerale, aparate (ampermetru, voltmetru, celule de electroliza), machete ale unor elemente din instalatiile utilizate in industria chimica (schimbatoare de caldura, vase de amestecare cu diferite agitatoare, e.t.c.);
obiecte elaborate sau construite special: au ca scop didactic, asa cum sunt modelele materiale, studierea anumitor structuri (vezi modelarea);
materiale cu reprezentari figurative: planse reprezentand Sistemul periodic al elementelor, desene realizate pe tabla, pe folii sau coli de hartie, diapozitive, filme video, dischete, CD-uri;
reprezentari simbolice: diferite tipuri de formule (formula bruta, moleculara, de conformatie, de configuratie), formule matematice utilizate in rezolvarea problemelor de chimie.
II. Materiale pentru formarea si exersarea deprinderilor: aparatura din laboratoarele de chimie (sticlaria si ustensile de laborator).
III. Materiale destinate rationalizarii timpului in cadrul lectiilor de chimie: conturul unei instalatii folosita in industria chimica.
IV. Materiale de evaluare a rezultatelor invatarii: fise, teste.
In ceea ce priveste mijloacele tehnice folosite in scoala, acestea sunt: diaproiectorul, casetofonul, retroproiectorul, aparatura video, calculatorul. Superioritatea mijloacelor tehnice audio-vizuale fata de toate mijloacele demonstrative traditionale, consta in posibilitatea de care dispunem de a prezenta realitatea in toata complexitatea ei in fata elevilor, de a stabili o legatura intre elevi si lumea exterioara.
Dupa opiniile unor cercetatori, gradul de solicitare psihica al fiecarei categorie de materiale didactice creste pe masura ce coboram pe scara urmatoare (cunoscuta sub denumirea de scara lui Dale) si scade pe masura ce urcam pe ea:
XII. Simboluri verbale (orale sau scrise);
XI.Simboluri figurale ( imagini, scheme, figuri utilizate);
X. Inregistrari sonore;
IX. Imagini fixe (diafilme, diapozitive, fotografii)
VIII. Imagini mobile (filmul)
VII. Imagini TV.
VI.Imagini statice (expozitii, muzee)
V. Observatii intentionate (excursii de studiu)
IV.Observatii bazate pe observatii stiintifice
III.Scene dramatizate
II Experimente inventate (simulari, machete, e.t.c.)
I. Experienta semnificativa directa (activitatea reala, proprie a elevului).
Faptul ca aceste mijloace ii ajuta pe elevi sa retina mai mult timp si in proportie mai mare cunostintele invatate este ilustrat de M. Couadenzio in tabelul urmator:
|
Forma de prezentare a informatiilor |
Date retinute dupa 3 ore |
Date retinute dupa 3 zile |
|
Numai oral |
70% |
10% |
|
Numai vizual |
72% |
20% |
|
Oral si vizual |
85% |
65% |
Cercetare metodica personala. Organizarea activitatii de cercetare
pedagogica
Asupra intrebarii "ce este cercetarea"? nu exista, dupa cum apreciaza John Wise, o definitie universal acceptata. Ea este o activitate profunda si diversa, uneori pueril de simpla, alteori deosebit de complexa, uneori neconcludenta sau alteori mai putin practic; se desfasoara in arhive ca si in laborator, pe santier sau in scoala, este opera unui efort solitar sau al unor echipe complexe.
Nota definitorie a cercetarii este, insa cautarea in vederea cunoasterii. Aceasta inseamna a cauta informatii si fapte, la nevoie a le provoca, a le decanta si evalua in vederea obtinerii unui spor de cunoastere.
In consecinta vom considera cercetarea pedagogica ca fiind o strategie proiectata si realizata in scopul de a surprinde relatii si fapte noi intre componentele actiunii educationale si de a elabora, pe aceasta baza, solutii optime pentru problemele procesului educational. Pentru ca rezultatele unei cercetari pedagogice sa fie valide este necesar parcurgerea unui ansamblu de etape si subetape implicate, reciproc dependente, subordonate urmatoarei ierarhizari:
1. Delimitarea temei de cercetat:
1.1. Sesizarea temei prin diagnosticarea starii initiale de invatare;
1.2. Formularea operationala a problemei de cercetat.
2. Proiectarea cercetarii:
2.1. Stabilirea obiectivelor cercetarii;
2.2. Formularea ipotezei cercetarii;
2.3. Elaborarea unui proiect de cercetare unitar si coerent.
3. Organizarea si desfasurarea cercetarii pedagogice - presupune aplicarea in practica a proiectului cercetarii, respectiv realizarea de demersuri in scopul verificarii ipotezei, precum si inregistrarea datelor.
4. Analiza, prelucrarea si interpretarea rezultatelor obtinute de elevi.
5. Stabilirea concluziilor finale ale cercetarii.
1. Delimitarea problemei de cercetat
Prin aplicarea unui test sumativ la sfarsitul unei unitati de invatare "Solide ionice" la doua clase a IX a, A si B, am diagnosticat nivelul de asimilare a cunostintelor elevilor la un moment dat. Problema de cercetat este inregistrarea rezultatelor la invatatura la sfarsitul unitatii de invatare pentru a stabili progresul sau regresul elevilor.
2. Stabilirea obiectivelor cercetarii
Obiectivul central urmarit a fost acela de a stabili daca este posibila sau nu anularea lacunelor de cunostinte , dezvoltarea la elevi a gandirii, a imaginatiei, a rationamentului logic, a puterii de selectie si abstractizate.
Ipoteza de la care am plecat a fost aceea ca toti elevii din grupul de cercetat vor reusi sa atinga nivelul minimal acceptabil al performantei pentru noua unitate de invatare.
Elaborarea unui proiect de cercetare unitar si coerent a constat in:
Am ales drept unitate de invatare "Solide ionice"- clasa a IX a, A(27 elevi) si B(27 elevi) , parcursa timp de 7 ore, clasele sunt eterogene fiind formate din elevi buni la invatatura si elevi mai slabi la invatatura.
Metodele de cercetare psihopedagogica la care am apelat sunt:
- metoda observatiei sistematice - consta in urmarirea intentionata, metodica si sistematica a comportamentului elevilor aflati in situatii de invatare. In general aceasta metoda presupune ca elevii sa fie urmariti spontan pentru a le cunoaste cat mai profund trasaturile esentiale.
- metoda experimentala sau experimentul psihopedagogic didactic - Experimentul presupune modificarea intentionata a conditiilor de invatare. Asadar experimentul psihopedagogic este o observatie provocata cu o rigoare si precizie mai mare decat observatia.
- metoda testelor si a altor probe de evaluare scrisa - Testele reprezinta un instrument de cercetare alcatuit dintr-un ansamblu de itemi care vizeaza cunoasterea fondului informativ si formativ dobandit de elevii investigati, respectiv identificarea prezentei/absentei a unor capacitati , competente, comportamente. Itemul este o intrebare, o sarcina de lucru (teoretica, practica sau teoretico-practica) care alcatuieste o cota parte independenta a unui test. In afara testelor se mai utilizeaza, ca probe de evaluare scrisa, fisele de lucru, temele efectuate acasa.
Unitatea de invatare "Solide ionice"
|
Continuturi |
C.P. |
Activitati de invatare |
Resurse |
Evaluare |
|
NaCl, NaOH- Proprietati fizico-mecanice |
2.1. |
Investigarea proprietatilor fizice si mecanice pe baza fiselor de lucru concepute de elevi |
Activitate in grup in scopul caracterizarii NaCl si NaOH din punct de vedere fizic si din punct de vedere mecanic |
Investigatia |
|
Solubilitatea. Factorii care influenteaza solubilitatea |
2.2 |
Proiectarea unei investiga- tii referitoare la solubilita- tea unei substante ionice in apa |
Activitate de grup si individuala, in scopul definirii solubilitatii, stabilirii factorilor care influenteaza solubilitate |
Investigatia Observarea sistematica |
|
NaCl, NaOH - proprietati chimice |
2.1 3.2 2.3 |
Investigatia proprietatilor chimice cu fise de lucru. argumentarea utilizarilor substantelor studiate Formulare de concluzii extrase din fisele de obs. |
Activitate in grup in scopul identificarii pro- prietatilor chimice Activitate individuala Activitate individuala de modelare a reactiilor chimice |
Observarea sistematica Proba scrisa Referat |
|
Cristale ionice. Legatura ionica |
2.6 2.4 2.4 2.6 3.1 1.1 1.2 2.6 |
Explorarea structurii cris- taline a NaCl Generarea de ipoteze asupra formarii legaturii ionice Explicarea proprietatilor fizice si mecanice ale NaCl Extrapolarea notiunii de structura ionica la NaOH Extrapolarea formarii leg. ionice de la NaCl la NaOH |
Activitate in grup in scopul generarii unui model al structurii NaCl Activitate individuala de modelare a structurii cristaline a NaCl Activitate in grup in Scopul formularii de explicatii plauzibile referitoare la proprie- tatile NaCl Activitate in grup in scopul analizarii retelelor ionice ale altor substante Activitate in grup cu scopul deducerii struc- turii cristaline ionice a altor substante |
Fisa de Lucru Proba Scrisa- test de evaluare |
3. Organizarea si desfasurarea cercetarii pedagogice
Desfasurarea propriu-zisa a cercetarii pedagogice consta in aplicarea in practica a etapelor prevazute in proiectul cercetarii, in vederea verificarii ipotezei. Ea presupune efectuarea de activitati specifice in vederea atingerii obiectivelor invatarii. Mi-am propus ca rezultatele la testul de evaluare sumativa de la sfarsitul unitatii de invatare "Solide ionice" sa fie bune.
In primele 6 ore destinate acestei unitati de invatare am imbinat latura informativa a conceptelor prezentate cu cea formativa, ce anume va sti sa faca elevul la sfarsitul parcurgerii acestei unitati de invatare; daca elevii stiu sa transfere in practica unele cunostinte insusite anterior; daca stiu sa selectioneze esentialul dintr-o informatie scrisa data; daca elevii pot face abstractizari; sa imagineze modelarea unor fenomene chimice; daca pot parcurge un rationament logic; daca pot construi un model concret pe baza unui model abstract.
Gradul de atingere a obiectivelor vizate prin parcurgerea unitatii de invatare se evalueaza prin administrarea unei probe de evaluare sumativa prin aplicarea unui test de evaluare sumativa.
Proba de evaluare sumativa - "Solide ionice"
Continuturi vizate
Interactii intre atomi si ioni;
Clorura de sodiu, hidroxidul de sodiu - structura, proprietati fizice si chimice si utilizari.
Timp de lucru: 40'
Termeni specifici urmariti: ioni, legatura ionica, retele cristaline, cristale ionice,
solubilitate.
Obiective urmarite prin proba de evaluare:
Itemii construiti in vederea masurarii nivelului de atingere a obiectivelor de evaluat sunt arondate dupa cum urmeaza:
O1 - itemii1, 2 si 4;
O2 - itemii 3, 4 si 7;
O3 - itemii 1, 2 si 5;
O4 - itemul6;
O5 - itemul 2;
TEST DE EVALUARE SUMATIVA
Item 1
Completeaza tabelul:
|
Formula chimica |
Ioni pozitivi |
Ioni negativi |
Formula ionica |
|
CaO |
|
|
|
|
Na2S |
|
|
|
1punct
Item 2
Oxidul de magneziu are acelasi tip de retea cristalina ca si clorura de sodiu. Reprezinta reteaua cristalina a acestui compus, specificand ionii din retea si natura legaturilor.
1,5puncte
Item 3
Ce proprietate specifica solidelor ionice da informatii asupra naturii stratificate a acestora ?
1punct
Item 4
Cum se numesc substantele care se sfarama in unitati structurale mai mici ?
1punct
Item 5
Aranjeaza fluorurile de magneziu, de strontiu si de calciu in ordinea cresterii punctelor de topire.
I,5puncte
Item 6
In tabelul de mai jos sunt indicate valorile solubilitatii clorurii de sodiu (NaCl) exprimate in g NaCl la 100g apa, la diferite temperaturi:
|
Temperatura |
00 |
200 |
400 |
600 |
800 |
1000 |
|
Solubilitatea |
35,7 |
36,0 |
36,6 |
37,3 |
38,4 |
39,8 |
a) Traseaza graficul solubilitatii in functie de temperatura;
b) Afla valoarea solubilitatii la 300 C;
c) Formuleaza o concluzie pe baza datelor din tabel.
2puncte
Item 7
Care din urmatoarele proprietati ale hidroxidului de sodiu nu ilustreaza caracterul bazic al acestuia ?
a) Reactia cu acidul clorhidric cu formare de sare si apa;
b) Reactia cu clorura de fier (II) cu formarea hidroxidului de fier (II );
c) Absorbtia apei din atmosfera;
d) Virajul fenolftaleinei in prezenta hidroxidului de sodiu.
1punct
Nota: se acorda un punct din oficiu.
Rezultatele testului de evaluare sumativa
|
Numar de puncte |
% din punctaj |
a IX a A % din totalul elevilor |
a IX a B % din totalul elevilor |
|
10 |
100 |
15,7 |
|
|
9 |
90 |
19,6 |
9,2 |
|
8 |
80 |
16,5 |
16,7 |
|
7 |
70 |
28,4 |
23,5 |
|
6 |
60 |
7,0 |
27,5 |
|
5 |
50 |
10,7 |
15,0 |
|
4 |
40 |
|
|
|
3 |
30 |
|
3,0 |
|
2 |
20 |
|
4,0 |
|
1 |
10 |
|
|
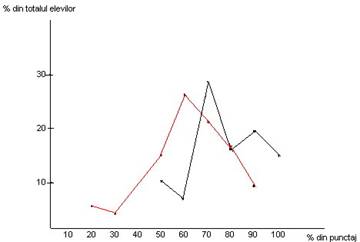
4. Analiza, prelucrarea si interpretarea rezultatelor obtinute de elevi
In aceasta cercetare de tip experimental- ameliorativ, asa cum am stipulat in prima parte a lucrarii, am pornit de la ipoteza ca toti elevii din cele doua clase vor reusi sa atinga nivelul minim acceptabil al performantei (5 puncte ≈ nota 5) dupa parcurgerea unitatii de invatare "Solide ionice."
Respectand graficul de administrare al probelor din unitatea de invatare, in conformitate cu planificarea calendaristica, la cele doua clase au rezultat evaluari ce au confirmat in cea mai mare parte ipoteza de lucru.
Aspectele cantitative care rezulta din tabelul si graficul de mai sus sunt sintetizate prin urmatoarele:
Din punct de vedere calitativ, analiza produselor arata diferente de intelegere-asimilare de cunostinte, informatii atat in plan semantic, cat si in plan configurativ. Gradul de aplicabilitate al informatiilor-cunostintelor, conform piramidei Bloom-Skinner, difera sensibil de la clasa la clasa conform demonstratiei exprimata de graficul rezultatelor.
Faptul ca doar la clasa a IX a A s-a obtinut punctaj maxim (15,7%), la cealalta clasa, acestea neexistand , ba chiar mai mult la aceasta clasa apar rezultate sub limita baremului minim acceptat, demonstreaza diferente de stil in predare, diferente notabile de receptare a informatiilor intre cele doua efective de elevi, grad diferit de intelegere-asimilare, dar mai ales un grad sporit de aplicabilitate la clasa a IX a A
5. Stabilirea concluziilor finale ale cercetarii
Din analiza cantitativa si calitativa a produselor, din analiza graficului si din experienta proprie dobandita la catedra, indeosebi in urma acestor tipuri succesive de experimente, se poate afirma ca ipoteza propusa este viabila confirmandu-se justetea ei.
Teoriile moderne ale invatarii aplicabile si in domeniul ce face obiectul acestei cercetari se constituie intr-un sistem integrat avand ca subsisteme unele procedee didactice moderne aplicabile in cadrul invatamantului traditional romanesc reformat.
Se observa necesitatea dirijarii actului invatarii pe baza ancorarii cunostintelor noi cu vechile informatii in sistem concentric in asa fel incat sa se creeze o corelare directa a acestora pentru o foarte buna asimilare si crestere a gradului de aplicabilitate.
Deoarece prin acest experiment am sesizat diferente notabile intre nivelul de pregatire al elevilor demonstrate prin neatingerea varfului piramidal al lui Bloom-Skinner de cea mai mare parte a elevilor de la clasa a IX a B , se impun anumite masuri:
- ameliorarea schemei de invatare eficienta prin aplicarea metodelor moderne de invatare cum ar fi invatarea diferentiata, chiar individualizata conform atat particularitatilor de varsta specifice cat mai ales particularitatilor individuale si impletirea diferentierii individualizate cu munca in echipe de nivel sensibil egal sau cu diferente in functie de posibilitatile intelectuale a componentilor echipei. Practic acest lucru se poate realiza prin diversificarea fiselor de lucru, a fiselor de recuperare, si indeosebi a celor de tip experimental prin aplicarea stricta a principiilor accesibilitatii; se observa ca este necesara o pregatire suplimentara a elevilor prin meditatii si consultatii in vederea stimularii apetitului elevilor (indeosebi din clasa B) pentru chimie.
- este absolut necesar, in dirijarea corecta a activitatii de invatare, pentru o temeinica pregatire , cadrul didactic sa aplice cele mai moderne metodologii didactice ca: instruirea programata, problematizarea, descoperirea, armonizate substantial cu metodele traditionale validate in decursul evolutiei invatamantului romanesc. Aceste metodologiile didactice trebuie aplicate in toate etapele procesului de predare- asimilare. Eficienta lor va fi evidenta atat in cadrul procesului de invatare a noilor cunostinte cat si in cadrul aceluia de repetare si aprofundare a cunostintelor deoarece ceea ce intereseaza este nu atat aspectul notelor , ci problema de fond, aceea a verificarii stadiului de dezvoltare a elevilor, problema cunoasterii progreselor treptate, de zi cu zi, a cunoasterii dificultatilor intampinate de elevi in procesul de invatare.
Ideea care trebuie retinuta, in special, este faptul ca profesorul singur trebuie sa adapteze o metoda didactica sau alta la conditiile determinate de specificul colectivului; deci profesorul trebuie "sa gaseasca" , nu "sa aleaga" metoda. A gasi metoda de invatare inseamna , de fapt, a sti sa transferi conceptele psihopedagogiei , fundamente ale teoriilor moderne ale invatarii, in conditiile concrete ale unei discipline de invatamant si specifice particularitatilor colectivului. Cercetarea pe care am realizat-o nu ar fi completa daca s-ar opri la acest stadiu, deoarece inovarea invatarii eficiente trebuie efectuata permanent conform modificarilor programei disciplinei de invatamant, a noilor cerinte mereu reactualizate.
Proiectarea activitatii didactice
Proiectarea demersului didactic este acea activitate desfasurata de profesor care consta in anticiparea etapelor si a actiunilor concrete de realizare a predarii. Proiectarea demersului didactic presupune:
- lectura personalizata a programei;
- planificarea calendaristica;
- proiectarea secventiala a unitatilor de invatare;
- proiectarea secventiala a lectiilor.
Proiectarea secventiala a lectiilor
Proiectarea unei lectii este cea mai detaliata si vizeaza: obiectivele operationale, unitatile de continut corespunzatoare, sarcina didactica de indeplinit (introducere in tema, comunicare de noi cunostinte, formarea unor deprinderi, recapitulare si sistematizare, e.t.c.), modul de lucru cu elevii (frontal pe grupe, individual sau o combinatie intre acestea), metoda de invatamant, materiale didactice si mijloace tehnice utilizate, exercitii si probleme, experiente, probe de evaluare, teme pentru activitatea individuala desfasurata in afara scolii, bibliografie.
Proiectarea unei lectii conceputa ca o activitate mentala de anticipare amanuntita a ceea ce urmeaza sa realizeze profesorul in clasa (laborator, cabinet), se materializeaza intr-un document cunoscut sub denumirea de proiect didactic.
Realizarea unui proiect didactic se bazeaza pe:
- cunoasterea elementelor de baza ale proiectarii didactice;
cunoasterea si stapanirea principiilor de invatamant si a tehnologiei didactice;
- cunoasterea clasei de elevi;
- capacitatea de anticipare si gandire creatoare a profesorului.
Alcatuirea proiectului didactic tine atat de pregatirea stiintifica a profesorului, precum si de maiestria lui didactica. Desi nu se pot da retete, modele general-valabile (actul didactic fiind prin excelenta, un act de creatie) se poate propune ceea ce am numi un proiect cadru, un film general al evenimentelor oricarei lectii.
Proiectarea lectiilor de chimie; Tipuri fundamentale de lectii
Lectia constituie forma organizatorica principala in care se desfasoara activitatea educatorului cu elevii unei clase.
Lectia poate fi considerata ca un microsistem care cuprinde toate componentele sistemului numit proces de invatamant (obiective, continuturi, metodologie, forme de organizare).
In functie de sarcina didactica indeplinita, in marea varietate pe care o prezinta structura lectiilor, acestea pot fi grupate in:
- lectia de dobandire de noi cunostinte - Trasatura comuna a acestor lectii o constituie faptul ca vizeaza in principal predarea/invatarea unor continuturi noi, care se realizeaza in diverse moduri si prin diferite tipuri de activitati. Lectia de dobandire de noi cunostinte se realizeaza prin diferite metode: conversatia, modelarea, demonstratia, experimentul, e.t.c.
- lectia mixta (lectia de verificare si predare de cunostinte) - este tipul cel mai des utilizat deoarece cuprinde toate etapele de lucru ale procesului de invatare; in cazul acestor lectii se realizeaza permanent legatura dintre cunostintele care se verifica si cele ce urmeaza a fi predate.
- lectia de rezolvari de probleme - Prin acest tip de lectii se poate modela: intelegerea relatiei dintre structura si proprietatile substantelor; un sistem chimic de gandire bazat pe transformarile chimice ale substantelor dictate de legi proprii chimiei; capacitatea elevilor de a formula ipoteze, de a corela cunostinte teoretice, de a selecta pe cele necesare rezolvarii chestiunii in cauza; capacitatea intelectuala de a formula generalitati, de a trage concluzii. Exercitiile si problemele trebuie sa fie clar formulate si sa corespunda prin enunt continuturilor stiintifice a lectiilor sau capitolelor, sa fie tipice, si deci, sa fie un model pentru rezolvarea altor exercitii si probleme.
lectia de laborator - trebuie sa aiba in vedere controlul special al elevilor in vederea efectuarii corecte a experimentului dupa ce, in prealabil, acestora li se face un scurt instructaj de protectie a muncii. Lectia de laborator se desfasoara pe baza unui plan bine stabilit si profesorul va trebui sa observe modul de lucru al fiecarui elev pentru ca acesta sa faca legatura intre suportul teoretic si desfasurarea efectiva a reactiei chimice.
- lectia de fixare si consolidare, recapitulare si sistematizare a cunostintelor - se aplica dupa studierea unui grup de lectii a unui capitol, la sfarsit de semestru sau de an scolar si se desfasoara pe baza unui plan de recapitulare intocmit de profesor sau de profesor si elevi impreuna. Pentru a trezi interesul elevilor, lectia de recapitulare trebuie sa aiba in vedere insusirea temeinica a cunostintelor printr-un mod de regrupare a materiei urmarindu-se asocierea notiunilor si completarea acestora, unele pe altele.
PROIECT DIDACTIC NR. 1
Data:
Clasa: a VIII a
Titlul lectiei: Proprietati chimice generale ale metalelor
Tipul lectiei: lectie de dobandire de noi cunostinte
Timp de lucru: 2 ore
Obiective informative
La sfarsitul lectiei elevii trebuie sa numeasca proprietatile chimice ale metalelor: - Reactia cu nemetalele;
- Reactia cu acizii;
- Reactia cu apa;
- Reactia cu compusii altor metale
Obiective formative
- Dezvoltarea capacitatii de a observa si valorifica datele experimentale;
- Formarea unui limbaj stiintific specific chimiei;
- Formarea deprinderilor de munca in grup.
Obiective operationale:
La sfarsitul lectiei toti elevii vor fi capabili:
O1 - Sa stabileasca proprietatile chimice ale metalelor pe baza activitatilor experimentale;
O2 - Sa coreleze reactivitatea chimica cu pozitia in Sistemul Periodic;
O3 - Sa argumenteze comportarea metalelor in functie de pozitia in seria activitatii chimice;
O4 - Sa modeleze grafic principalele proprietati ale metalelor prin intermediul ecuatiilor
reactiilor chimice;
O5 - Sa rezolve exercitii si probleme care implica cunoasterea proprietatilor chimice ale
metalelor.
Metode si procedee didactice utilizate
conversatia euristica
observatia
invatarea prin descoperire
modelarea
experimentul
exercitiul
Mijloace de invatamant
manual cl. a VIII a
retroproiectorul
Materiale didactice
substante si ustensile de laborator
fise de lucru
folii pentru retroproiector
Desfasurarea lectiei
1. Moment organizatoric: verificarea prezentei, stabilirea conditiilor pentru
desfasurarea lectiei
2. Captarea atentiei
Dintre cele 105 elemente cunoscute, 81 sunt metale. Dat fiind multiplele utilizari in practica ale metalelor (constructii metalice, conductori electrici, acoperiri metalice, e.t.c.) cat si importanta lor pentru organismul uman este importanta cunoasterea proprietatilor chimice ale metalelor.
3. Enuntarea obiectivelor la nivelul elevilor
La sfarsitul acestor ore va trebui ca elevii sa indice principalele proprietati chimice ale metalelor si sa efectueze calcule chimice pe baza cunoasterii acestora.
4. Anuntarea lectiei noi:
Se va scrie pe tabla titlul lectiei: "Proprietatile chimice ale metalelor"
5. Comunicare de noi cunostinte:
Informatie: Metalele reactioneaza cu substante simple si substante compuse conducand la diferite tipuri de compusi cu multiple aplicatii practice. Deoarece au tendinta de a ceda electroni pentru a-si realiza configuratie stabila de gaz rar metalele prezinta caracter electropozitiv. Prin cedare de electroni, metalele se oxideaza devenind ioni pozitivi. Cu cat un atom cedeaza mai usor electroni, cu atat el are un caracter electropozitiv mai pronuntat.
I. Reactia metalelor cu nemetalele
1. Arderea metalelor in clor: (experiente demonstrative)
In trei cilindri in care s-a obtinut clor (din KClO3 si HCl) se introduce cate o lingura de ars cu sodiu, cupru si fier.
Sarcina de lucru: scrierea ecuatiilor reactiilor chimice: compararea reactivitatii chimice ale metalelor.
2Na + Cl2 = 2NaCl
Cu + Cl2 = CuCl2
2Fe + 3Cl2 = 2FeCl3
Concluzii: 1. Metalele ard in clor formand saruri.
2. Reactivitatea fata de clor a celor trei metale scade in ordinea Na, Fe, Cu.
Generalizare
METAL + HALOGEN → HALOGENURA
2. Arderea metalelor in oxigenul din aer (experiente frontale):
Se presara pulberi metalice (Mg, Zn, Fe, Cu, Al ) in flacara unui bec. Se observa culoarea si intensitatea culorii.
Se scriu ecuatiile reactiilor ce au avut loc:
2Mg + O2 = 2MgO
2Zn + O2 = 2ZnO
3Fe + 2O2 = Fe3O4
2Cu + O2 = 2CuO
4Al + 3O2 = 2Al2O3
Concluzii: 1. metalele ard in oxigenul din aer formand oxizi.
2. Reactivitatea fata de oxigenul din aer scade in ordinea: Mg, Al, Zn, Fe, Cu.
Generalizare
METAL + OXIGEN → OXID METALIC
3. Reactia metalelor cu sulful (experiente demonstrative):
Se obtin amestecuri stoechiometrice din substantele Fe si S, Al si S, Zn si S, Mg si S care sunt plasate in patru colturi ale unei site de azbest care se incalzeste puternic. Se observa rapiditatea cu care se aprinde amestecurile.
Se scriu ecuatiile reactiilor chimice:
Fe + S = FeS
2Al + 3S = Al2S3
Zn + S = ZnS
Mg + S = MgS
Concluzie: 1 Metalele reactioneaza cu sulful formand saruri;
2 Reactivitatea celor 4 metale fata de sulf scade in ordinea: Mg, Al, Zn, Fe.
Generalizare
METAL + SULF = SULFURA
Informatie: Metalele pot reactiona si cu carbonul, azotul, fosforul si hidrogenul. Aceste proprietati pot fi prezentate in schema:
METAL + CARBON → CARBURA
METAL + AZOT → AZOTURA
METAL + FOSFOR → FOSFURA
METAL + HIDROGEN → HIDRURA
Activitate independenta: particularizarea schemei pentru magneziu.
II. Reactia metalelor cu acizii
1. Reactia unor metale cu acidul clorhidric (HCl) (experiente demonstrative):
In 5 eprubete in care s-a introdus solutie de acid clorhidric se introduc metalele: Zn, Fe, Mg, Al, Cu. Se stabileste natura gazului care se degaja din cele 5 eprubete cu ajutorul unui chibrit aprins.
Se scriu ecuatiile reactiilor ce au avut loc:
Zn + 2HCl =ZnCl2 + H2↑
Fe+ 2HCl = FeCl2 + H2↑
2Al + 6HCl = 2AlCl3 + 3H2↑
Mg + 2HCl = MgCl2 + H2↑
Cu + HCl = nu are loc
Concluzie: 1. Zn, Fe, Mg, Al substituie hidrogenul din acizi. Cuprul nu substituie
hidrogenul din acizi (cuprul nu reactioneaza cu HCl)
2. Reactivitatea celor 5 metale scade in ordinea Mg, Al, Zn, Fe, Cu.
Informatie: Metalele au tendinte diferite de a forma ioni pozitivi (caracter electropozitiv).
Seria activitatii metalelor numita si seria Beketov-Volta sau seria activitatii electrochimice s-a stabilit calitativ si cantitativ prin masuratori electrochimice.
Seria activitatii chimice a metalelor:
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Pb H2 Cu, Hg, Ag, Pt, Al
Creste caracterul electropozitiv
←-----------------------
scade activitatea chimica
-----------------------→
Pozitia ocupata de un metal in seria activitatii electrochimice permite sa se prevada modul in care se va comporta acesta in diferite reactii chimice.
Metalele situate inaintea hidrogenului in seria activitatii metalelor inlocuiesc hidrogenul din acizi.
METAL + Acid →Sare + H2
cu caracter
puternic
electropozitiv
2. Reactia cuprului cu acidul sulfuric si acidul azotic (experiente demonstrative):
In doua eprubete se introduc cantitati mici de cupru . In prima eprubeta se adauga o cantitate mica de H2SO4 concentrat, iar in a doua eprubeta acid azotic concentrat.
Observatii: In eprubeta cuprul se acopera la inceput cu un strat de culoare neagra (CuO), apoi se formeaza o solutie de culoare albastra (CuSO4).
In a doua eprubeta se observa formarea NO2 de culoare brun-roscat datorita oxidarii monoxidului de azot cu oxigenul din aer si o solutie de culoare albastra Cu(NO3)2.
Sarcini de lucru: Scrierea ecuatiilor reactiilor chimice:
a) Cu + H2SO4 = CuO + SO2↑ + H2O
CuO + H2SO4 = CuSO4 + H2O
----------------
Cu +2H2SO4 = CuSO4 + SO2↑ + 2 H2O
b) 3Cu + HNO3 = 3CuO + 2NO↑ + H2O
CuO + 2 HNO3 = Cu(NO3)2 + H2O
Se amplifica cu trei ecuatia a 2 a si insumand cele doua ecuatii se obtine:
3 Cu + 8 HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
2NO↑ + O2 = 2NO2
Generalizare
Metalele situate in seria activitatii metalelor dupa hidrogen (dar aproape de el ) cu caracter electropozitiv mai slab, reactioneaza numai cu acizii cu caracter oxidant:
METAL+ ACID= SARE +OXID+ H2O
cu caracter cu caracter de nemetal
slab electropozitiv oxidant in treapta
de valenta
inferioara
Metalele cu caracter slab electropozitiv: Au, Pt nu reactioneaza cu acizii.
III. Reactia metalelor cu apa:
1. Reactia Na cu apa (experienta demonstrativa):
Intr-un cristalizator cu apa se introduce o bucatica de sodiu uscata si curatata de stratul de oxid. Dupa terminarea reactiei se adauga in cristalizator cateva picaturi de solutie de fenolftaleina.
Observatii: Na reactioneaza cu H2O formand o solutie bazica de NaOH (dupa adaugarea fenolftaleinei, solutia se coloreaza in roz) si se degaja un gaz H2.
Scrierea ecuatiei reactiei chimice:
2Na + 2H2O = 2NaOH + H2↑
Generalizare
Metalele cu caracter electropozitiv puternic (situate in grupa I si II principala sau la capatul din stanga seriei activitatii metalelor) reactioneaza cu apa.
IV. Reactia metalelor cu compusi ai altor metale
1. Reactia Al cu Fe2O3 (experienta demonstrativa):
Intr-un creuzet se introduc pulbere de aluminiu si oxid de fier(III). Pentru a declansa reactia se introduce si o panglica de magneziu in amestecul din creuzet. Se aprinde panglica de magneziu.
Observatii: Al si Fe2O3 reactioneaza energic cand flacara a ajuns in amestec.
Scrierea ecuatiei reactiei chimice:
2Al + Fe2O3 = 2Fe + Al2O3
Generalizare
Orice metal poate reduce ionii tuturor metalelor situate dupa el in seria activitatii metalelor.
METAL 1 + OXID DE METAL 2 → OXID DE METAL 1 + METAL 2
2. Reactia metalelor cu sarurile unor metale
Reactia fierului cu solutia de sulfat de cupru (CuSO4) (experienta demonstrativa):
Intr-o eprubeta ce contine o solutie de sulfat de cupru se introduce un cui de fier.
Observatii: Pe cuiul de fier se depune un strat roscat de cupru metalic, iar solutia se decoloreaza.
Scrierea ecuatiei reactiei chimice:
Fe + CuSO4 = FeSO4 + Cu↓
Concluzie: Fierul fiind un metal cu caracter electropozitiv mai puternic decat cuprul, poate reduce ionii de cupru la cupru metalic.
Generalizare
Un metal poate reduce ionii tuturor metalelor situate dupa el in seria activitatii electrochimice si poate fi la randul sau redus din compusi de catre metalele care il preced.
METAL 1 + SARE DE METAL 2 → SARE DE METAL1 + METAL 2
6. Fixarea noilor cunostinte:
Se realizeaza prin intrebari legate de noile proprietatile chimice ale metalelor:
7. Tema pentru acasa:
Exercitiul 1.
Ce cantitate de oxigen este necesara pentru a transforma 5 kg Al, 97% in oxid de aluminiu? Ce cantitate de oxid se obtine?
Exercitiul2.
Cat gaz se obtine din reactia dintre 10 g cupru si acid sulfuric?
PROIECT DIDACTIC NR. 2
Data
Clasa: a IX a
Titlul lectiei: Pile electrice
Tipul lectiei: mixta
Obiective:
A. Obiective cognitive Elevii trebuie:
A1 - sa dobandeasca cunostinte care cup0rind legi, teorii, principii ale proceselor chimice in scopul formarii limbajului chimic;
A2 - sa explice semnificatia chimica a unor fenomene intalnite la functionarea pilelor electrice;
A3 - sa utilizeze cunostintele teoretice acumulate si deprinderile practice dobandite in realizarea unor instalatii simple.
B. Capacitati si deprinderi intelectuale Elevii trebuie sa posede urmatoarele abilitati:
B1 - Operarea cu limbaj specific chimiei;
B2- redare a unor simboluri si formule chimice a elementelor, substantelor si reactiilor chimice;
B3 -planificarea, organizarea si indeplinirea sarcinilor intelectuale pentru efectuarea de experiente;
B4 - dezvoltarea mobilitatii gandirii tehnice prin corelatii interdisciplinare.
C. Comunicare Deprinderile de comunicare includ capacitatea elevilor de a:
C1 - identifica surse de informatie potrivite pentru anumite scopuri si de a le prezenta folosind un limbaj chimic;
C2 - lucra in echipa: sa preia responsabilitati, sa schimbe informatii, sa inteleaga rolul si relatiile in cadrul grupului.
D. Deprinderi practice
D1 - manuirea corecta a ustensilelor, instalatiilor si a reactivilor chimici;
D2 - formularea unor ipoteze si verificarea lor referitoare la pile electrice;
D3 - efectuarea de experiente dupa instructiuni scrise sau verbale;
D4 - aplicarea cunostintelor din domeniul chimiei in interpretarea fenomenelor din natura; utilizarea lor in viata cotidiana.
Metode de invatamant folosite: conversatia euristica
expunerea
modelarea
experimentul
descoperirea dirijata
Resurse materiale: sistemul periodic, ustensile de laborator, aparatura, reactivi
necesari obtinerii unei pile electrice in laborator; fise de lucru,
folii retroproiector.
Desfasurarea lectiei
1. Moment organizatoric:
La cererea profesorului, elevul de serviciu prezinta situatia prezentei elevilor in clasa, iar profesorul noteaza absentele in catalog; se verifica tinuta elevilor si aspectul clasei, se stabileste linistea si atmosfera propice activitatii didactice.
2.Verificarea cunostintelor:
a) verificarea temei pentru acasa;
b) verificarea cunostintelor din lectia anterioara seva realiza prin rezolvarea unei fise de lucru.
Fisa de lucru
1. Stabileste numerele de oxidare in : HNO3, HCl, FeS2, Cu, KMnO4.
2. Stabileste, utilizand algoritmul cunoscut, coeficientii urmatoarelor procese redox:
Cu + HNO3 = Cu(NO3)2 + NO + H2O
KClO3 + HCl = KCl + Cl2 + H2O
c) activitate independenta: rezolvarea exercitiului 1 si verificarea prin sondaj , la tabla, a solutiilor.
d)activitate frontala: rezolvarea exercitiului 2 la tabla.
3. Trecerea la lectia noua:
Enuntarea noilor obiective
La sfarsitul orei, elevii vor trebui sa de fineasca si sa indice principalele parti componente alei pilei electrice si sa prezinte principalele pile electrice folosite in practica.
Anuntarea lectiei noi: Se anunta si se scrie la tabla titlul lectiei noi: "Pile electrice"
Prezentarea noului continut; conducerea invatarii:
Informatie: Pilele electrice sau celulele electrochimice au constituit , pana la jumatatea secolului al XIX-lea singura sursa de curent electric.
In zilele noastre se utilizeaza o gama variata de astfel de dispozitive pentru aparatura electronica, pentru toate tipurile de masini.
Celulele electrochimice sunt cunoscute si sub denumirea de celule galvanice, dupa numele fizicianului Luigi Galvani (1737-1798) sau celule voltaice dupa numele fizicianului italian A. Volta (1745-1827), inventatorul bateriei.
Informatie: Definirea celulelor electrochimice:
Celulele electrochimice (pile electrice) sunt dispozitive cu ajutorul carora energia chimica se transforma in energie electrica avand la baza procese redox.
Alcatuirea unei pile electrice (Pila Daniell)
Activitate independenta: Pila electrica Zn-Cu
Materiale necesare si mod de lucru: Se alcatuieste montajul din figura de mai jos:
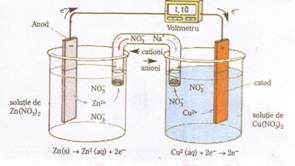
Pentru realizarea montajului de mai sus se utilizeaza:
- 1 pahar Berzelius in care se introduc 100ml solutie 1M de azotat de zinc (Zn(NO3)2) si o placuta de zinc (anod).
- 1 pahar Berzelius in care se introduc 100ml solutie azotat de cupru (Cu(NO3)2) 1M si o placuta de cupru (catod).
- un tub in forma de U (puntea de sare) ce contine o solutie de azotat de sodiu astupat la capete cu vata sau hartie de filtru.
- conductori metalici care leaga cei doi electrozi ; aparat de masura - voltmetru.
Concluzii: - La inchiderea circuitului se observa ca acul indicator al voltmetrului este deviat, ceea ce inseamna ca prin circuit trece curent electric.
- Acul indicator revine la valoarea zero, daca se scoate puntea de sare din cele doua solutii, deoarece s-a intrerupt circuitul electric.
- Dupa un timp suficient de lung constatam ca electrodul de zinc isi micsoreaza masa, iar masa electrodului de cupru creste.
Ecuatiile reactiilor chimice care au loc in pila electrica Zn-Cu, sunt:
in semicelula anodului(-): Zn → Zn2+ +2e- (oxidare)
in semicelula catodului(+): Cu2+ +2e- → Cu (reducere)
Reactia globala: Zn + Cu2+ → Zn2+ + Cu
Generalizare
- Anodul(-) este electrodul unde are loc oxidarea (Zn → Zn2+ +2e-);
- Creste numarul ionilor pozitivi care vor fi neutralizati de ionii negativi din puntea de sare;
- Catodul(+) este electrodul unde are loc reducerea (Cu2+ +2e- → Cu);
- Creste numarul ionilor negativi care vor fi neutralizati de ionii pozitivi din puntea de sare.
Simbolizarea elementului galvanic:
(-) Zn(s) Zn2+(aq)Cu2+(aq) Cu(s) (+)
↑ ↑ ↑
simbolulpunteasimbolul
anodului de sare catodului
Informatie: Cele mai cunoscute pile electrice folosite in practica sunt: pila Daniel, elementul Leclanche′ (pila uscata), acumulatorul cu plumb.
Prezentarea principalelor caracteristici ale pilelor electrice enumerate mai sus sunt prezentate in fise de instruire care sunt impartite fiecarui elev in parte. Folosind aceste fise, printr-un dialog intre profesor si elev se stabilesc partile componente si reactiilor redox ce au loc la electrozi.
Fisa de instruire (I)
Acumulatorul cu Pb (bateria)
i.
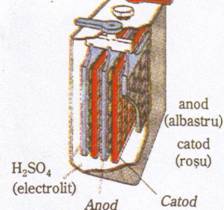
Caracteristici: 1. grup de celule galvanice legate in serie;
2. folosit ca baterie la autoturisme;
3. electrozii sunt confectionati din placi de plumb sub forma de gratare umplute: plumb spongios la anod (-); dioxid de plumb (PbO2), la catod(+);
4. electrolitul in care sunt introdusi electrozii este o solutie de H2SO4 cu ρ=1,29g/cm3, c=38℅;
5. prin functionare, acumulatorul se descarca si solutia de H2SO4 se dilueaza; reincarcarea se realizeaza prin legarea electrozilor la redresor avand loc procesul redox invers.
Ecuatiile proceselor redox:
Anod(-): Pb(s) + SO42-(aq) → PbSO4(s) + 2e- (oxidare)
Catod (+): PbO2(s) + 4H4+(aq) + SO42-(aq) + 2e- → PbSO4(s) + 2H2O(l)
Ecuatia redox globala generatoare de curent este:
Pb(s) + PbO2(s) + 4H4+(aq) +2SO42-(aq) → 2PbSO4(aq) + 2H2O(l)
Fisa de instruire (II)
Pila Leclanche′ (pila uscata)
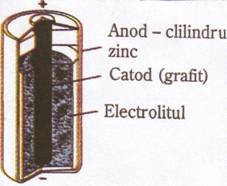
Caracteristici
1. inventata in 1867 de chimistul francez George Leclanche′;
2. anodul este un cilindru mic de zinc umplut cu pasta formata din NH4Cl, ZnCl2 si
material inert de umplutura (electrolitul);
3. catodul este confectionat din grafit inconjurat de MnO2 din mijlocul cilindrului.
Reactiile redox sunt complexe , dar simplificat se reprezinta:
Anod(-): Zn(s) → Zn2+(aq) + 2e- (oxidare)
Catod(+): 2NH4(aq) + 2MbO2(s) + 2e- → Mn2O3(s) + 2NH3(aq) + H2O(l) (reducere).
Informatie: Aceste pile electrice putin modificate sunt folosite pentru numeroase aparate portabile, jucarii, lanterne, minicalculatoare, ceasuri, dispozitive medicale.
4. Fixarea noilor cunostinte
Prin dialog profesor-elev se rezolva urmatorul exercitiu aplicativ:
Raspunde la urmatoarele cerinte:
a) Ce este o celula electrochimica?
b) Cum ia nastere curentul electric in pila electrica?
c) Ce este anodul? Ce este catodul?
d) Ce pile electrice ati cunoscut astazi?
5. Se noteaza si se apreciaza elevii care s-au remarcat pe parcursul desfasurarii lectiei.
6. Tema pentru acasa: Din manual cls. a IX a, ex. 1,2,3,4, pag. 95.
PROIECT DIDACTIC NR. 3
Data
Clasa: a IX a
Titlul lectiei: Starea solida
Tipul lectiei: rezolvare de probleme si exercitii
Obiectivele lectiei
A. Obiective cognitive: Elevii trebuie:
A1 - sa utilizeze cunostinte teoretice si deprinderile practice dobandite in efectuarea unor experiente;
A2 - sa dobandeasca un sistem de cunostinte pe baza caruia sa se formeze si sa se dezvolte limbajul cu termeni chimici .
B. Capacitati si deprinderi intelectuale:
B1 - Dezvoltarea mobilitatii in gandirea tehnica, prin corelatii interdisciplinare.
C. Comunicarea:
C1 - Prezentarea informatiilor si folosirea limbajului chimic in enunturi adecvate.
D. Rezolvare de probleme:
D1 - Recunoasterea tipului de problema;
D2 - Selectarea celei mai adecvate metode de rezolvare a unei probleme date;
D3 - Analiza datelor obtinute in urma unor experiente de laborator si interpretarea rezultatelor obtinute.
E. Deprinderi practice:
E1 -Manuirea corecta a aparaturii, a ustensilelor;
E2 - Efectuarea unor experimente de laborator si intocmirea referatului de lucru pe baza observatiilor facute.
Metode si procedee utilizate: conversatia euristica,
descoperirea dirijata,
modelarea,
activitate independenta si de grup,
experimentul,
algoritmizarea,
problematizarea.
Resurse: sistem periodic, ustensile si aparatura de laborator, material bibliografic
documentar, proiectii referitoare la tema.
Desfasurarea lectiei
I. Moment organizatoric: se trec absentii in catalog, se fac observatii asupra aspectului clasei.
II. Verificarea - invatarea prin rezolvari de probleme:
Impreuna cu elevii se stabileste un plan de discutii asupra temei "Starea solida":
Pentru a verifica aceste notiuni se rezolva urmatoarea fisa de lucru:
Fisa de lucru
Exercitiul 1.
Arata semnificatia urmatoarelor concepte:
a) celula elementara;
b) retea ionica;
c) substanta casanta;
d) electrolit.
Exercitiul 2.
Inscrie in spatiul liber din stanga cifrelor substantelor din coloana A, literele corespunzatoare ale proprietatilor retelelor acestora din coloana B:
A B
.1 C (grafit) a) conduce curentul electric in
. 2 NaCl conditii obisnuite;
. 3 N2 b) metal;
. 4 Na c) solubil in apa;
d) casant;
e) prezinta retea covalenta;
f) prezinta retea moleculara;
Exercitiul 3.
Se da schema circuitului electric:
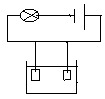 sol NaCl
sol NaCl
a)Folosind ustensilele de la mesele de lucru, realizati experimental aceasta
schema. Ce observati?
b) Ce proprietate fizica a substantelor este pusa in evidenta prin acest experiment?
Exercitiul 4.
Indica pentru fiecare din urmatoarele substante: H2O, CaCO3, Ag, Si, CO2
a) tipul de retea cristalina in stare solida;
b) natura fortelor de retea.
Exercitiul 5.
In laborator, pentru identificarea ionului (Cl-), se utilizeaza reactia cu azotatul de argint. Ce cantitate de clorura de sodiu s-a luat in lucru, daca pentru identificare s-au folosit 20g solutie de AgNO3, 8,5% ?
Exercitiul 6.
Se verifica conductibilitatea sarii geme care contine 80% NaCl si impuritati insolubile. Pentru aceasta se iau 200g sare si se amesteca cu 200ml apa. Afla concentratia procentuala a solutiei de sare.
Rezolvarea fisei de lucru
Exercitiul 1
a) Celula elementara este cea mai mica unitate structurala care pastreaza proprietatile substantei si prin repetarea pe toate directiile formeaza reteaua cristalina.
b) Retelele ionice sunt aranjamente ordonate de ioni pozitivi si negativi intre care se stabilesc legaturi ionice.
c) Substanta casanta este substanta solida care se sfarama la lovire, sub actiunea unei forte exterioare.
d) Electrolitul reprezinta o substanta solida care conduce curentul electric numai in solutie sau topitura.
Exercitiul 2.
a),e). 1.C (grafit)
c),d). 2. NaCl
f). 3. N2
b).4. Na
Exercitiul 3.
a) Se realizeaza experimental circuitul electric. Se observa aprinderea becului in solutia de NaCl.
b) Conductibilitatea electrica . Solidele ionice conduc curentul electric numai in solutie si topitura.
Exercitiul 4.
H2O: a) retea moleculara;
b) legaturi de hidrogen.
CaCO3: a) retea ionica;
b) legatura ionica.
Ag: a) retea metalica;
b) legatura metalica.
Si:a) retea covalenta (atomica);
b) legatura covalenta nepolara.
C (diamant , grafit): a) retea covalenta (atomica);
b) legatura covalenta nepolara.
CO2:a) retea moleculara;
b) forte de dispersie.
Exercitiul 5.
Datele problemeiRezolvare
mNaCl = ? AgNO3 + NaCl = AgCl↓ + NaNO3
ms = 20g AgNO3 pp. alb
cAgNO3 = 8,5%
MAgNO3 = 108 + 14 + 3.16 = 170
MNaCl = 23 + 35,5 = 58.5
c = md.100/msunde:
md = masa substantei dizolvate (AgNO3)![]()
ms = masa solutiei = 20g sol. AgNO3
8,5 = md.100/20 => md = 8,5.20/100 => md = 1,7g AgNO3
1mol AgNO3----- ----- ----1mol NaCl
170g AgNO3----- ----- ----58,5g NaCl
1,7g AgNO3----- ----- -----x g NaCl
x = 1,7.58,5/170 => x = 0,585g NaCl
Pentru identificarea ionului (Cl-) s-au folosit 0,585g NaCl.
Exercitiul 6
Datele problemei: Rezolvare:
mNaCl = 200g 100g NaCl. impur----- ----- ------ 80g NaCl pur
VH2O = 200ml H2O 200g NaCl impur----- ----- -------x g NaCl pur
80% NaCl pur
cNaCl = ? x = 200.80/100 => x = 160g NaCl
VH2O = 200ml = 200cm3c = md/ms .100 unde: md = masa substantei dizolvate(NaCl)
ρH2O = 1g/cm3ms = masa solutiei.
md = 160g NaCl
ms = md + mH2O => ms = 160g NaCl + 200gH2O =>
ms = 360g sol. NaCl
c = 160.100/360 => c = 44,44%
Concentratia solutiei de sare pentru a verifica conductibilitatea electrica a solutiei de sare este c = 44.44%.
Pe tot parcursul activitatii, profesorul solicita elevilor sa completeze exercitiile notate in fisa, urmareste rezolvarea lor si le dirijeaza activitatea.
III. Notarea elevilor care s-au evidentiat pe parcursul desfasurarii orei.
IV. Anuntarea temei pentru acasa:
Exista domenii ale existentei noastre in care este utilizata sticla si derivatele ei. Alcatuieste un referat avand ca obiect de studiu sticla, portelanul, ceramica. Va veti referi la structura, compozitie, obtinere, proprietati si mai ales sub ce forma sunt utilizate aceste materiale.
PROIECT DIDACTIC NR. 4
Data
Clasa: a IX a
Titlul lectiei: Variatia caracterului metalic in grupa si perioada
Tipul lectiei: Lectie de laborator
Obiective
A. Obiective cognitive: Elevii trebuie:
A1. - sa dobandeasca teorii si principii ale proceselor chimice specifice in scopul formarii limbajului chimic adecvat;
A2 - Sa utilizeze cunostintele teoretice acumulate si deprinderile practice dobandite in efectuarea unor experiente in realizarea unor instalatii simple.
B. Capacitati si deprinderi intelectuale
B1.- elevii trebuie sa-si dezvolte mobilitatea gandirii tehnice prin corelatii interdisciplinare.
C. Comunicarea
C1 - elevii trebuie sa prezinte informatiile, observatiile referitoare la variatia caracterului metalic, sa intocmeasca referatul lucrarii de laborator;
C2 - elevii trebuie sa se acomodeze cu lucrul in echipa, sa preia diferite roluri si responsabilitati.
D. Rezolvare de probleme
D1 - elevii trebuie sa aplice algoritmii in rezolvarea problemelor teoretice si practice;
D2 - elevii trebuie sa poata analiza datele obtinute in urma unor experiente de laborator si sa interpreteze rezultatele obtinute.
E. Deprinderi practice
E1 - elevii trebuie dirijati sa manuiasca corect ustensilele si reactivii chimici necesari intelegerii conceptului de caracter metalic;
E2 - elevii trebuie sa poata efectua experiente dupa instructiuni verbale sau scrise;
E3 - elevii trebuie sa poata formula ipoteze si sa le verifice.
Metode si procedee de invatamant : conversatia
modelarea
experimentul
problematizarea
algoritmizarea
Material didactic folosit
-ustensile de laborator: stativ de eprubete, cutit, cristalizator, sticla de ceas, cleste, bec de gaz, spatula;
- sticle cu reactivi: (Na, Mg, K, Al).
Desfasurarea lectiei:
I. Moment organizatoric:
- notarea absentelor;
repartizarea elevilor pe grupe de cate 4;
verificarea ustensilelor de laborator si a reactivilor de pe mesele de lucru.
II. Anuntarea temei si organizarea activitatilor
Se scrie pe tabla titlul temei: "Variatia caracterului metalic in grupa si perioada."
Elevii vor defini notiunea de caracter metalic si procesul de ionizare care are loc.
Informatie: Caracterul metalic (electropozitiv) reprezinta tendinta atomilor unui element de a ceda electroni si de a forma ioni pozitivi.
M → Mn+ + ne-; n- numarul de electroni cedati.
III. Noua lectie
Lucrarea de laborator este structurata conform fisei de lucru individuale prezentata mai jos pe care o primeste si o completeaza fiecare elev.
Informatie: Dupa efectuarea celor 4 experiente se trag urmatoarele concluzii:
1.Sodiul, magneziul si aluminiul sunt metale care se afla in aceeasi perioada. Reactivitatea acestora fata de O2 Si fata de H2O scade de la sodiu la aluminiu fiind o masura a caracterului electropozitiv al acestora.
NaMg Al
Creste caracterul electropozitiv
←------------
Generalizare
Caracterul electropozitiv, in perioada, scade de la stanga la dreapta deoarece in acest sens creste numarul de electroni care trebuie cedati.
2. Atat sodiul cat si potasiul care se gasesc in aceeasi grupa reactioneaza cu O2 si, respectiv cu apa, insa dintre cele doua metale, potasiul reactioneaza mult mai usor decat sodiul. Deci caracterul electropozitiv al K este mai mare decat al Na.
Generalizare
Caracterul electropozitiv , in grupele principale creste de sus in jos deoarece creste numarul de straturi, forta de atractie a nucleului scade, iar electronii sunt cedati mai usor.
IV. Notarea elevilor care s-au evidentiat pe parcursul desfasurarii orei.
V. Tema pentru acasa: Folosind concluziile de la activitatea experimentala, scrie referitor la elementul 11Na:
a) configuratia electronica si pozitia in sistemul periodic;
b) procesul prin care isi realizeaza configuratie stabila;
c) enumerarea cateva din proprietatile fizice;
d) Aprecieri asupra caracterului chimic al elementului;
e) Reactiile chimice posibile ale Na cu: O2, O2 (exces), Cl2. H2, S, H2O si respectiv HCl
Fisa de lucru individuala
|
Denumirea experiment |
Materiale necesare |
Mod de lucru |
Reactia chimica |
Observatii |
|
Reactia Na cu O2 Si cu H2O |
O bucatica de Na; hartie de filtru; cristalizator cu apa; fenolftaleina; sticla de ceas. |
Taie cu atentie pe hartia de filtru, o bucata de sodiu cat un bob de mazare. Sodiul se pune in cristalizator cu apa si fenolftaleina. Observati desfasurarea reactiei |
4Na+O2=.. 2Na+2H2O =.. |
|
|
Reactia K cu O2 si cu H2O |
O bucatica de K; hartie de fil- tru; cristalizor cu apa si fenolftaleina; sticla de ceas. |
Taie pe hartia de filtru o bucata deK cat un bob de mazare. K se pune in cristalizator cu apa si fenolftaleina. Observati desfasurarea reactiei. |
2K+O2=.. 2K+2H2O=. |
|
|
Reactia Mg cu O2 si H2O |
Foita de Mg; cleste de fier; 2 eprubete; apa, fenolftaleina; bec de gaz. |
Arde foita de Mg. Scrumul pune-l in epru- beta cu apa si incalzeste. Pune in alta eprubeta cu apa si fenolftaleina o foita de Mg. Fierbe amestecul. |
Mg+ O2=.. ..+ H2O=.. Mg+ H2O=. |
|
|
Reactia Al cu O2 |
Pulbere de Al; spatula; bec de gaz. |
Azvarle in fla- cara becului de gaz pulbere de Al. Scrie observatiile. |
Al+ O2=... |
|
PROIECT DIDACTIC NR. 5
Data:
Clasa: a IX a
Titlul lectiei: Solide ionice
Tipul lectiei: lectie de fixare si consolidare, recapitulare si sistematizare a cunostintelor
Continuturi vizare: Interactii intre atomi si ioni; Clorura de sodiu, hidroxidul de sodiu- structura, proprietati fizice si chimice, utilizari.
Obiective: Elevul trebuie sa fie capabil:
O1 - sa utilizeze corect vocabularul stiintific, abrevierele in conteste relevante;
O2 - sa identifice afirmatii corecte referitoare la fapte stiintifice, relatii, procese;
O3 - sa foloseasca modele care demonstreaza intelegerea conceptelor stiintifice si a relatiilor dintre ele;
O4 - sa formuleze concluzii ca urmare a interpretarii unui set de date;
O5 - sa aplice cunostintele dobandite intr-un alt contest.
Metode de invatare folosite: conversatia
algoritmizarea
modelarea
problematizarea
Material didactic: test de evaluare
Desfasurarea lectiei
I. Moment organizatoric: captarea atentiei si crearea unei atmosfere propice desfasurarii lectiei.
II. Reactualizarea notiunilor teoretice cu privire la solide ionice.
III. Evaluarea scrisa a cunostintelor referitoare la solide ionice.
Utilizarea testelor docimologice reprezinta o alternativa a examinarii traditionale, care asigura o mai mare obiectivitate a nivelului de pregatire a elevilor. Profesorul va explica modalitatea de rezolvare si completare a testului in functie de tipul itemilor.
Itemii construiti in vederea nivelului de atingere a obiectivelor de evaluat sunt arondati acestora dupa cum urmeaza:
O1 - itemii 1,2,4;
O2 - itemii 3,4,7;
O3 - itemii 1,2,5;
O4 - itemul 6;
O5 - itemul 2.
Test de evaluare
1. Completeaza tabelul:
|
Formula chimica |
Ioni pozitivi |
Ioni negativi |
Formula ionica |
|
CaO |
|
|
|
|
Na2S |
|
|
|
1 punct
2. Oxidul de magneziu are acelasi tip de retea cristalina ca si clorura de sodiu. Reprezinta reteaua cristalina a acestui compus, specificand ionii din retea si natura legaturilor.
1,5puncte
3. Ce proprietate specifica solidelor ionice da informatii asupra naturii stratificate a acestora?
1punct
4. Cum se numesc substantele care se sfarama in unitati structurale mai mici?
1 punct
5. Aranjeaza fluorurile de magneziu, de strontiu si de calciu in ordinea crescatoare a punctelor de topire. Explicati.
1,5 puncte
6. In tabel sunt indicate valorile solubilitatii NaCl exprimate in g NaCl la 100g apa la temperaturi diferite:
|
Temperatura |
00 |
200 |
400 |
600 |
800 |
1000 |
|
Solubilitatea |
35,7 |
36,0 |
36,6 |
37,3 |
38,4 |
39,8 |
a) Traseaza graficul solubilitatii in functie de temperatura;
b) Afla valoarea solubilitatii la 300 C;
c) Formuleaza o concluzie pe baza datelor din tabel.
2 puncte
7.Care dintre urmatoarele proprietati ale hidroxidului de sodiu (NaOH) nu ilustreaza caracterul bazic al acestuia?
a) reactia cu acidul clorhidric cu formare de sare si apa;
b) reactia cu clorura de fier (II) cu formarea hidroxidului de fier (II);
c) absorbtia apei din atmosfera;
d) virajul fenolftaleinei in prezenta hidroxidului de sodiu.
1 punct
Nota: se acorda un punct din oficiu.
V. Interpretarea rezultatelor
Pe baza notelor obtinute de fiecare elev se pot alcatui diferite situatii statistice: media clasei; % note minime; % note maxime.

|
Politica de confidentialitate |
| |
Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |