CHIMISMUL MIERALELOR
1 Compozitia chimica a scoartei terestre
 Investigatiile geofizice indica o
diviziune concentrica a Pamantului in scoarta, manta
si nucleu. Scoarta terestra are o grosime de aproximativ 36 km
sub continente si o grosime de 10-13 km sub oceane. Partea superioara
a scoartei este alcatuita intr-o mare proportie din roci
sedimentare si materiale neconsolidate care acopera un fundament de
roci magmatice si metamorfice. Clarke si Washington (1924) au estimat
ca partea superioara a scoartei (cam 10 km) are urmatoarea
compozitie: 95% roci endogene (magmatice si metamorfice), 4% argile,
0,75% gresii si 0,25% calcare. Deoarece ponderea cea mai importanta o
au rocile endogene, compozitia chimica a scoartei terestre va fi
foarte apropiata de compozitia chimica medie a acestora.
Investigatiile geofizice indica o
diviziune concentrica a Pamantului in scoarta, manta
si nucleu. Scoarta terestra are o grosime de aproximativ 36 km
sub continente si o grosime de 10-13 km sub oceane. Partea superioara
a scoartei este alcatuita intr-o mare proportie din roci
sedimentare si materiale neconsolidate care acopera un fundament de
roci magmatice si metamorfice. Clarke si Washington (1924) au estimat
ca partea superioara a scoartei (cam 10 km) are urmatoarea
compozitie: 95% roci endogene (magmatice si metamorfice), 4% argile,
0,75% gresii si 0,25% calcare. Deoarece ponderea cea mai importanta o
au rocile endogene, compozitia chimica a scoartei terestre va fi
foarte apropiata de compozitia chimica medie a acestora.
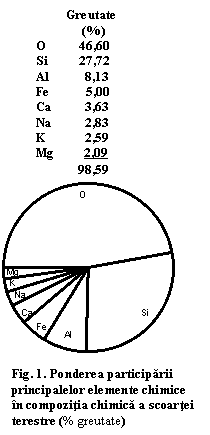
O detaliere a participarii diferitelor elemente chimice in compozitia chimica a scoartei terestre arata faptul ca opt elemente chimice participa in proportie de 99% la alcatuirea acesteia: O, Si, Al, Fe, Ca, Na, K, Mg (fig.1). Data fiind participarea importanta a oxigenului, se poate deduce faptul ca in compozitia scoartei terestre predomina mineralele care sunt compusi ai oxigenului, in special silicati (contin cantitati importante de Si si Al), dar si oxizi si carbonati. Astfel mineralele considerate petrogenetice apartin in special acestor grupe de minerale.
Celelalte elemente chimice cu raspandire mai redusa se pot comporta diferit. Spre exemplu elementele chimice ca Pb, Cu, Zn, Hg, etc., pot prezenta local anumite concentratii cu importanta economica. Elemente ca Rb sunt dispersate ca elemente minore in multe minerale care contin K, dar nu se concentreaza niciodata. Alte elemente chimice ca Zr sau Ti sunt concentrate in minerale specifice: zircon ZrSiO4, respectiv rutil TiO2 si ilmenit FeTiO3.
2 Compozitia chimica a mineralelor
Definitia mineralului se refera la o substanta solida, cristalizata, cu o anumita structura atomica si o compozitie chimica definita. Compozitia chimica a unui mineral este definita in situatia in care se cunoaste raportul atomilor din structura si este reprezentata prin formula chimico-structurala. Intr-o astfel de formula, toate elementele chimice au indici diferiti, nu neaparat numere intregi. Exemple: CaMg[Si2O6], Ca(Mg0,2Fe0,8)[Si2O6]. Componenta structurala a acestei formule chimice este data de urmatoarele caracteristici:
a) Prin formula chimico-structurala este redata compozitia chimica a celulei elementare. Am vazut in capitolul precedent ca ea se poate scrie astfel incat sa se arate exact numarul de atomi din structura (ex.: Zn4S4) sau se poate scrie astfel incat sa reflecte raportul atomilor in celula elementara, aplicandu-se suplimentar multiplicitatea acestora (ex.: ZnS cu Z=4).
b) Formula chimico-structurala permite gruparea in paranteze rotunde a unor elemente chimice care pot ocupa pozitii similare in structura unui mineral si evidentierea in paranteze drepte (uneori rotunde) a unor unitati structurale caracteristice unor clase (grupe) de minerale prin grupari anionice caracteristice. De exemplu in formula Ca(Mg0,2Fe0,8)[Si2O6], Mg si Fe ocupa acelasi tip de pozitie structurala, in timp ce Ca si Si ocupa pozitii diferite. Gruparea [Si2O6] arata in primul rand ca mineralul respectiv este un silicat care are ca unitate structurala primara caracteristica tetraedrul SiO4, iar raportul Si:O=2:6 al gruparii anionice arata ca silicatul respectiv este un piroxen in care tetraedrele se leaga prin varfuri formand niste unitati structurale secundare unidimensionale (lanturi).
Compozitia mineralelor se exprima insa si prin alte tipuri de formule. De exemplu formula Ca(Mg0-1Fe1-0)[Si2O6] exprima compozitia chimica a unei intregi serii de minerale in care participarea elementelor chimice variaza intre doua limite, date de doua minerale cu chimism diferit: CaFe[Si2O6] si CaMg[Si2O6]. Un alt exemplu poate fi formula Ca(Mg,Fe)[Si2O6] care include de asemenea compozitia chimica a unei serii de minerale in care Mg si Fe se pot substitui reciproc, dar nu se mai mentioneaza explicit limitele in care acestea pot participa. Aceste tipuri de formule se utilizeaza pentru mineralele cu chimism variabil pe care le vom descrie in capitolul 5.
Formulele chimico-structurale ale mineralelor indica in general doar acele elemente chimice cu participare importanta. In afara de acestea insa, in compozitia mineralelor pot interveni si elemente minore, cu participare cantitativa foarte redusa (ppm) (ex.: Rb, Cs, Sr, etc.). De obicei acestea nu se reprezinta in formula chimico-structurala, dar se mentioneaza posibilitatea si limitele interventiei lor in compozitia chimica a mineralelor (ex.: Rb, Cs, Sr, Ba in compozitia chimica a feldspatilor).
Determinarea formulei chimico-structurale a unui mineral presupune in primul rand realizarea unei analize chimice care sa indice participarea cantitativa a elementelor chimice in compozitia mineralului respectiv. Sunt necesare apoi calcule ale acestor analize bazate pe cunoasterea de principiu a structurii (regulile de ocupare a unor pozitii de catre atomii determinati prin analiza chimica) pentru a se ajunge la formula chimico-structurala si implicit la descrierea completa a mineralului prin definirea structurii si a chimismului sau.
Chimismul mineralelor nu se opreste insa exclusiv la determinarea formulelor chimico-structurale ale mineralelor. Intelegerea proprietatilor fizice ale mineralelor si a comportamentului lor in procesele petrogenetice impun interpretari care sa ilustreze relatiile dintre minerale din punct de vedere chimic si structural. Aceste interpretari se bazeaza pe calcule suplimentare in urma carora chimismul unui mineral poate fi exprimat in functie de chimismul altor minerale si apoi poate fi reprezentat grafic in anumite diagrame care sa ilustreze sugestiv aceste relatii.
In cele ce urmeaza vom parcurge etapele de determinare si interpretare a chimismului mineralelor pe care le-am enumerat.
2.1. Tehnici analitice de determinare a compozitiei chimice a mineralelor
Determinarea compozitiei chimice a mineralelor se poate realiza prin:
a) metode calitative-detectarea si identificarea tuturor elementelor chimice componente;
b) metode cantitative-determinarea continutului elementelor chimice componente (in ppm sau %).
a) Metodele chimice clasice utilizeaza ca principiu realizarea unor reactii chimice si masurarea anumitor parametrii (volum, masa, culoare, etc.). Ele se mai numesc si metode umede deoarece implica trecerea mineralelor in solutie.
b) Metodele instrumentale reprezinta metode fizice de analiza deoarece se bazeaza pe interactiunea unei radiatii cu materia minerala. Principalele tipuri de radiatii utilizate in metodele de analiza instrumentala sunt radiatia luminoasa, radiatia X, electronii. Din punct de vedere al prepararii probelor, ele sunt in general metode uscate (cu exceptia spectrometriei de absorbtie atomica) deoarece mineralele se analizeaza in stare solida.
Alegerea metodei de analiza depinde de performantele acesteia in posibilitatea de detectare si masurare a elementelor chimice componente ale mineralului pe care dorim sa il analizam. Pentru alegerea metodei de analiza este necesara utilizarea preliminara a unor analize chimice calitative capabile sa puna in evidenta toate elementele chimice componente, combinate eventual si cu alte tipuri de analize (de exemplu analiza termica sau spectrometria de absorbtie in infrarosu). Din aceste analize vor rezulta criteriile de selectie a metodei (metodelor) de analiza cantitativa:
- Limitele de detectabilitate calitativa/cantitativa a unor elemente chimice: De exemplu daca mineralul contine Fe2+ si Fe3+, cei doi cationi nu pot fi separati prin fluorescenta de raze X si microanaliza chimica. Totusi daca alte criterii impun folosirea acestora, ele trebuie completate cu metode chimice clasice sau cu spectrometrie Mössbauer. Un alt exemplu il ofera Mg sau Na, elemente care se determina cu posibile erori prin fluorescenta de raze X si microanaliza. Pentru aceste elemente se prefera spectrometria de absorbtie atomica si metodele chimice clasice.
- Posibilitatea metodei cantitative alese de a detecta anumiti componenti: In cazul mineralelor hidratate, utilizarea metodelor instrumentale nu permite determinarea calitativa si cantitativa a H2O, oferind asa-numitele "analize anhidre". Obligativitatea utilizarii metodelor instrumentale impune si in acest caz utilizarea unor metode suplimentare: fie metode chimice clasice, fie analiza termica.
- Caracterul distructiv/nedistructiv al metodei cerut de modul de preparare al probei.
- Cantitatea de proba disponibila si dimensiunea cristalelor.
Din cele prezentate rezulta faptul ca nici o metoda de analiza cantitativa nu intruneste toate conditiile necesare pentru a determina compozitia chimica a oricarui mineral. De aceea, in general, pentru determinarea cat mai riguroasa a acestuia se foloseste o combinatie de metode de analiza care sa acopere in totalitate problemele pe care le ridica prezenta anumitor elemente chimice.
Tabel 1. Metode de analiza cantitativa a compozitiei chimice a mineralelor
|
Metode de analiza |
Principiul metodei |
Avantaje Limite |
|
|
Metode chimice clasice |
Analiza colorimetrica |
Realizarea unor reactii care dau culori caracteristice ce se compara cu culori ale solutiilor standard. |
Determina elemente chimice minore1. |
|
Analiza volumetrica |
Masurarea volumului unei solutii cunoscute necesara pentru a reactiona cu solutia unui material necunoscut cu masa (volum masurat). |
Determina elemente chimice majore2. |
|
|
Analiza gravimetrica |
Masurarea masei unor compusi rezultati prin precipitarea elementelor chimice din solutia mineralului analizat. |
||
|
Metode instrumentale |
Spectroscopia de absorbtie atomica |
Masurarea intensitatii absorbtiei unei radiatii luminoase cu λ~190 nm de catre atomii mineralului. |
Determina elemente chimice minore si majore; detectabilitate foarte buna pentru Na si Mg. |
|
Fluorescenta de raze X |
Separarea prin difractie si masurarea intensitatii radiatiei X fluorescente emise de atomii mineralului in urma bombardarii acestuia cu raze X. |
Determina elemente chimice minore si majore. Nu separa Fe2+ de Fe3+ si nu poate diferentia fazele volatile (ex.: H2O si CO2). Prezinta unele erori in determinarea P, Na si Mg. |
|
|
Microanaliza chimica (Analiza cu microsonda electronica) |
Separarea prin difractie si masurarea intensitatii radiatiei X fluorescente emise de atomii mineralului in urma bombardarii acestuia cu un fascicul de electroni. |
Determina elemente chimice minore si majore. Nu separa Fe2+ de Fe3+ si nu poate diferentia fazele volatile (ex.: H2O si CO2). Prezinta unele erori in determinarea P, Na si Mg. Limita de detectia absoluta pentru cele mai multe elemente este mai slaba decat la fluorescenta de raze X. permite analiza unor minerale cu volume mici (10-20μm3). |
|
Elemente cu continuturi cuprinse intre cateva ppm si cateva procente
Elemente cu continuturi cuprinse intre cateva procente si 100%
|
Tabel 2. Rezultatul unei analize chimice pe calcopirita |
|
|
Elemente componente |
Greutate |
|
Cu | |
|
Fe | |
|
S | |
|
Total | |
2..2. Calculul analizelor chimice
1. Calculul formulei chimico-structurale pe baza analizelor chimice. Rezultatele analizelor chimice prezentate anterior se dau in tabele care cuprind participarea cantitativa a elementelor chimice sau a oxizilor lor (pentru mineralele care contin oxigen) in procente de greutate sau ppm. Aceste tabele constituie baza de calcul a compozitiei chimice a mineralelor.
|
Tabel 3. Rezultatul unei analize chimice pe un feldspat |
|
|
Oxizi componente |
Greutate |
|
SiO2 | |
|
Al2O3 | |
|
CaO | |
|
Na2O | |
|
K2O | |
|
Total | |
In tabelul 2 sunt reprezentate rezultatele analizelor chimice pentru calcopirita in procente de greutate ale elementelor componente, iar in tabelul 3 sunt reprezentate rezultatele analizelor chimice in procente de greutate ale oxizilor elementelor componente pentru feldspat, mineral care contine oxigen. Procentele de greutate prezentate in aceste tabele nu reflecta raporturile atomice din structura mineralului astfel incat, pentru scrierea formulei chimico-structurale sunt necesare calcule suplimentare. Pentru toate mineralele, calculul are in vedere in primul rand raportarea procentelor de greutate la greutatile atomice ale elementelor componente sau la cele ale oxizilor componenti in cazul mineralelor care contin oxigen. In continuare, metodele de calcul sunt diferite in functie de particularitatile compozitionale si structurale ale mineralelor respective. Vom exemplifica principiul de calcul pe doua minerale: unul care nu contine oxigen (calcopirita) si unul care contine oxigen (feldspat).
In cazul analizelor chimice prezentate in tabelul 2, prin raportarea greutatilor procentuale ale elementelor Cu, Fe, si S la greutatile lor atomice se obtin proportiile atomice care arata raportul elementelor chimice in structura mineralului Cu:Fe:S=0,54:0,54:1,09, deci o formula chimica Cu0,54Fe0,54S1,09. Multiplicarea indicilor elementelor chimice cu ~2 duce la formula chimica CuFeS2 corespunzatoare din punct de vedere al raportului atomilor calcopiritei. Pentru ca aceasta sa capete semnificatia unei formule chimico-structurale este necesara cunoasterea numarului atomilor din celula elementara: 4 atomi de Cu, 4 atomi de Fe si 8 atomi de S. Rezulta astfel formula chimico-structurala a calcopiritei Cu4Fe4S8 sau CuFeS2 cu Z=
|
Tabel Calcopirita : calculul formulei chimico-structurale din analize chimice |
||||
|
Elemente componente |
Greutate |
Greutati atomice |
Proportii3 atomice |
Raporturi atomice |
|
Cu |
|
|||
|
Fe |
1 aprox. |
|||
|
S |
2 |
|||
|
Total | ||||
= greutatea (%)/greutatea atomica
In cazul mineralelor care contin oxigen (de exemplu feldspatul prezentat in tabelele 3 si 5), prima etapa de calcul consta in raportarea greutatii procentuale a oxizilor componenti la greutatile moleculare ale acestora, obtinandu-se astfel proportiile moleculare (numarul de molecule de oxizi care participa in compozitia mineralului respectiv). Pentru calculul participarii elementelor chimice se calculeaza in continuare proportiile atomice (cationice si anionice), respectiv numarul cationilor si numarul atomilor de oxigen care vor oferi raporturile atomice ale mineralului respectiv. Rezulta astfel formula chimica Si1,09Al0,41Ca0,01Na0,24K0,12O2,99 in care raportul (Si+Al):O=1,5:2,99~1:2, corespunzatoare unui feldspat. Pentru scrierea formulei sale chimico-structurale sunt necesare informatii de ordin structural: ocuparea pozitiilor cationice si numarul atomilor din celula elementara.
La feldspati, formula chimico-structurala generala este M4[T16O32] sau M[T4O8] cu Z= 4, unde M este o pozitie ocupata de cationi cu raze mari (K, Na, Ca) in coordinare 10, iar T este o pozitie in coordinare 4 ocupata de cationi cu raze mici (Si, Al). Aceasta formula generala arata suplimentar ca raportul elementelor chimice in celula elementara este M:T:O=1:4:8. Folosind aceste informatii putem grupa cationii din formula chimica prin paranteze rotunde in pozitiile M si T in ordine descrescatoare a participarii cantitative: (Na0,24K0,12Ca0,01)[(Si1,09Al0,41)O2,99]. Raportul (Na+K+Ca) : (Si+Al) : O= 0,37 : 1,5 : 2,99 = 0,99 :4,10 : 8~ 1 : 4 : 8 corespunde deci unui feldspat. Aceasta formula rezultata prin calculul analizei chimice nu este inca o formula chimico-structurala pentru ca ea reflecta doar raportul atomilor din structura, nu si compozitia chimica a celulei elementare.
Tabel 5. Feldspat alcalin: calculul formulei chimico-structurale din analize chimice
|
Oxizi componenti |
Greutate % |
Greutati moleculare |
Proportii4 moleculare |
Proportii atomice |
Numarul cationilor per 8 atomi de oxigen5 |
|||||
|
Proportii6 cationice |
Numarul atomilor de oxigen7 |
|||||||||
|
SiO2 |
|
T: |
||||||||
|
Al2O3 |
Al 1,094 |
|||||||||
|
CaO |
|
M |
||||||||
|
Na2O |
Na 0,655 |
|||||||||
|
K2O |
K 0,312 |
|||||||||
|
Total |
Total atomi de oxigen | |||||||||
|
Factorul de oxigen: 8/2,9886=2,67684 |
||||||||||
|
Formula chimico-structurala* |
|
(Na0,66K0,31Ca0,03)(Si2,91Al1,09)O8 cu Z=4 |
||||||||
|
(Na2,64K1,24Ca0,12)(Si11,64Al4,36)O32 |
||||||||||
|
Formula generala* |
|
(Na,K,Ca)(Si,Al)4O8 cu Z=4 |
||||||||
|
(Na,K,Ca)4(Si,Al)16O32 |
||||||||||
*Observatie: Succesiunea elementelor chimice in formula respectiva respecta conventiile de scriere a formulelor generale stabilite pentru fiecare grupa de minerale. In cazul unei pozitii cationice distincte, cationii se scriu intr-o paranteza care ii grupeaza in general in ordinea descrescatoare a participarii cantitative.
= greutatea (%)/greutateamoleculara a oxizilor
= proportii cationice . factorul de oxigen
sau numar de cationi; = proportia moleculara . numarul cationilor oxidului
= proportia moleculara . numarul atomilor de oxigen ai oxidului
Pentru a deveni o formula chimico-structurala este necesara o corectie a indicilor atomilor astfel incat suma lor sa fie egala cu 52 (sau 13 cu Z=4). Aceasta corectie se face luand ca referinta numarul atomilor de oxigen deoarece s-a observat ca la mineralele care contin oxigen nu exista pozitii structurale ale oxigenului neocupate cu atomi, in timp ce pozitiile cationice prezinta frecvent omisiuni, astfel incat numarul lor mediu pe celula elementara poate fi mai mic decat numarul din formula chimico-structurala generala. Asadar se ia in consideratie numarul de atomi de oxigen din celula elementara egal cu 32 (sau 8 atomi cu Z=4) si se recalculeaza numarul de cationi care le corespund acestora prin intermediul unui factor de proportionalitate numit factor de oxigen (egal cu raportul dintre numarul atomilor de oxigen din celula elementara si numarul atomilor de oxigen rezultati prin calculul analizei chimice). Se obtine astfel formula chimico-structurala a feldspatului din tabelul 5.
2. Calculul participarii termenilor finali din seriile izomorfe. La unele minerale, unele elemente chimice din pozitii structurale date pot fi substituite partial sau total de alte elemente. Aceasta substitutie determina aparitia unei serii de minerale, numite serii izomorfe (vezi capitolul 5). Pentru aceste minerale, in anumite situatii impuse de interpretarii ale chimismului nu este suficienta sau absolut necesara scrierea formulei chimico-structurale, fiind mai utila definirea pozitiei mineralului in seria izomorfa respectiva, in functie de termenii sai extremi (minerale cu compozitie chimica definita).
Un prim exemplu il constituie mineralele din seria olivinei cu formula generala, exprimata in pozitii structurale M1M2[SiO4]. Pozitiile M1 si M2 pot fi ocupate fara vreo anumita preferinta de Mg si Fe2+, astfel incat formula generala a mineralelor din seria olivinei se poate scrie (Mg,Fe2+)2[SiO4]. Aceasta serie este definita de doi termeni extremi, adica de doua minerale la care pozitiile M1 si M2 sunt ocupate in totalitate de Mg respectiv de Fe: forsterit Mg2[SiO4] si fayalit Fe2[SiO4]. Definirea pozitiei unui mineral in aceasta serie se poate face calculand compozitia sa chimica in functie de forsterit (Fo) si fayalit (Fa), adica participarea procentuala a Fo si Fa.
Tabel 6.: Mineral din seria olivinei (calculul formulei chimico-structurale din analize chimice)
|
Oxizi componenti |
Greutate % |
Proportii moleculare |
Proportii cationice |
In baza a 4 atomi de O |
Raporturi atomice |
||
|
SiO2 |
Si |
Si: | |||||
|
| |||||||
|
FeO |
Fe2+ |
| |||||
|
MnO |
Mn |
M1+M2: | |||||
|
MgO |
Mg | ||||||
Pentru a ilustra acest calcul luam ca exemplu un mineral din seria olivinei cu compozitia chimica prezentata in tabelul 6, a carui formula chimico-structurala calculata este (Mg1,13,Fe2+0,86Mn0,01)[SiO4]. Neglijand Mn, formula chimico-structurala devine (Mg1,14,Fe2+0,86)[SiO4]. Participarea procentuala a Fo si Fa se poate calcula fie prin participarea procentuala a atomilor de Mg si Fe, fie prin participarea procentuala a MgO si FeO:
a) Din proportii atomice : Mg 1,140 0,6708
![]() Fe 0,870 sau 0,5118
Fe 0,870 sau 0,5118 ![]() 56,7%Mg si 43,3%Fe
56,7%Mg si 43,3%Fe
2,010 1,1826
b) b) din proportii moleculare: Mg 0,67080
Fe 0,51176 ![]() 56,7%Mg
si 43,3%Fe
56,7%Mg
si 43,3%Fe
![]() 1,18256
1,18256
![]()
![]()
![]() 56,7% Forsterit si 43,3%Fayalit formula Fo56,7Fa43,3 sau Fo56,7
56,7% Forsterit si 43,3%Fayalit formula Fo56,7Fa43,3 sau Fo56,7
Un alt exemplu il constituie clinopiroxenii cu formula generala M2M1[T2O6]. In tabelul 7 este reprezentata compozitia chimica a unui clinopiroxen cu formula chimico-structurala (Ca0,93Mn0,03Na0,03K0,01)(Fe2+0,76Mg0,13 Fe3+0,10Al0,01) (Si1,98Al0,02)O6. Luand in consideratie doar componentii majori, formula chimico-structurala va deveni Ca1,00(Fe2+0,85Mg0,15)Si2O6. Pozitiile cationice M1 si M2 sunt ocupate de Ca, Mg si Fe. Astfel compozitia chimica a acestui mineral se poate defini in functie de:
A) trei termeni extremi ai seriei (Ca, Mg, Fe)2[Si2O6] definita de:
Wollastonit (Wo ) Ca2[Si2O6] (CaSiO3)
Enstatit (En) Mg2[Si2O6] (MgSiO3)
Ferosilit (Fs) Fe2[Si2O6] (FeSiO3)
7,30%En (Mg, MgO) 42,70%Fs (Fe, FeO) 50,00%Wo (Ca, CaO)
a) din
proportii cationice: Mg = 0,053
Fe = 0,310
![]() Ca = 0,363
Ca = 0,363
![]()
 Total
0,726
Total
0,726
 b) din proportii moleculare: MgO
= 0,053
b) din proportii moleculare: MgO
= 0,053
FeO = 0,310
![]() CaO
= 0,363
CaO
= 0,363
Total 0,726 Wo50,0Fs42,7En7,3
B) doi termeni extremi ai seriei Ca(Mg, Fe)2[Si2O6] definita de:
Diopsid (Di) CaMg[Si2O6]
Hedendergit (Hed) CaFe[Si2O6]
14,60%Di (Mg, MgO) 85,40%Hed (Fe, FeO)
a) din
proportii cationice: Mg = 0,053
![]() Fe = 0,310
Fe = 0,310
![]()

![]() Total 0,363
Total 0,363
b) din proportii moleculare: MgO = 0,053
![]() FeO = 0,310
FeO = 0,310
![]() Total 0,363 Di14,60Hed85,40 sau
Di14,60
Total 0,363 Di14,60Hed85,40 sau
Di14,60
Tabel 7.: Clinopiroxen (calculul formulei chimico-structurale din analize chimice)
|
Oxizi componenti |
Greutate |
Proportii moleculare |
Proportii cationice |
Numarul cationilor per 8 atomi de oxigen |
|||
|
SiO2 |
Si |
|
T: 2.00=2 |
||||
|
Al2O3 |
Al |
0,022 |
|||||
|
Fe2O3 |
Fe3+ |
0,008 |
M1: 1.01~1 |
||||
|
FeO |
Fe2+ | ||||||
|
MnO |
Mn8 | ||||||
|
MgO |
Mg | ||||||
|
CaO |
Ca |
M2: 0.964~1 |
|||||
|
Na2O |
Na | ||||||
|
K2O |
K | ||||||
Mn poate fi distribuit atat in pozitia M1, cat si in pozitia M2, intrucat analizele structurale arata ca ocupa frecvent ambele pozitii structurale
2.3. Reprezentarea grafica a compozitiei chimice a mineralelor
Pentru o caracterizare mai sugestiva a compozitiei chimice a mineralelor se folosesc reprezentari grafice, numite diagrame. Continutul acestora depinde de tipul de interpretare pe care trebuie sa il ilustreze. Cele mai utilizate diagrame sunt diagramele de chimism si diagramele de asociatie.
1.Diagramele (sistemele)de chimism se folosesc pentru a reprezenta compozitia chimica a unor minerale sau serii de minerale in functie de anumiti termeni chimici, numiti componenti, care pot reprezenta molecule chimice corespunzatoare unor minerale (ex.: forsterit Mg2SiO4, fayalit Fe2SiO4, wollastonit CaSiO3, etc.), molecule de oxizi (ex.: MgO, CaO, SiO2, etc.), cationi (Mg, Ca, Fe, etc.), etc. Din punct de vedere al marimilor de reprezentare, aceste diagrame se pot construi in procente de greutate (greutate %), proportii moleculare (molecular %), proportii atomice (atomic %), etc. In functie de numarul de componenti exista diagrame binare (doi componenti), ternare (trei componenti) sau polinare (mai multi componenti).

Tabel 8:
Compozitia mineralelor reprezentate in figura 2
|
Formula chimico-structurala |
Fe:Zn |
||
|
raporturi atomice |
raporturi procentuale |
||
|
ZnS | |||
|
(Zn0,86Fe0,14)S | |||
|
(Zn0,68Fe0,32)S | |||
|
FeS | |||
a) Diagramele (sistemele) binare se folosesc in special pentru reprezentarea chimismului mineralelor din serii izomorfe si pentru ilustrarea extinderii seriilor respective. Componentii acestei diagrame pot fi molecule chimice cu compozitia mineralelor extreme ale seriei, molecule ale oxizilor sau cationi care variaza ca participare in mineralele seriei respective.
In fig.2 este data diagrama binara ZnS-FeS pentru mineralele din seria sfalerit-troilit (Zn,Fe)S constituita in proportii cationice de participare a Zn si Fe (atomic %). Portiunea hasurata arata extinderea solutiei solide, cuprinzand minerale la care cationul predominant este zincul, fierul putand participa doar pana la 32% din totalul cationilor (serie izomorfa incompleta). Punctele 1-4 corespund mineralelor 1-4 din tabelul 8.
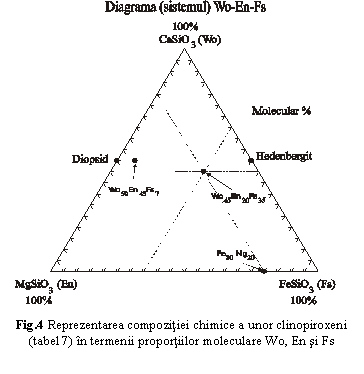
Tabel 9: Compozitia chimica a mineralelor reprezentate in fig. 4
|
Diopsid |
CaMg[Si2O6] |
Wo50En50 |
|
Hedenbergit |
CaFe[Si2O6] |
Wo50Fs50 |
|
Ortopiroxen 1 |
Mg0,4Fe1,6[Si2O6] |
En20Fs80 |
|
Clinopiroxen 2 |
CaMg0,86Fe0,14[Si2O6] |
Wo50En43Fs7 |
|
Clinopiroxen |
Ca0,9Mg0,4Fe0,7[Si2O6] |
Wo45En20Fs35 |
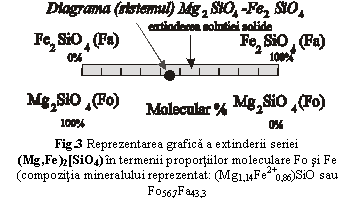
In fig.3 este reprezentat chimismul mineralelor din seria (Mg,Fe)2[SiO4] in proportii moleculare de participare a termenilor extremi, forsterit si fayalit (molecular %, egale cu proportiile moleculare ale oxizilor si cu proportiile cationice, vezi calculul de la pag.27). extinderea seriei izomorfe pe tot domeniul compozitional aratata prin hasurarea acestuia presupune faptul ca exista minerale cu orice compozitie intermediara intre forsterit si fayalit (serie izomorfa continua).
b) Diagramele (sistemele) ternare se folosesc de asemenea mai ales pentru reprezentarea mineralelor cu chimism variabil. Ca si in cazul diagramelor binare, ele pot contine extinderea solutiilor solide si/sau ilustrarea compozitiei chimice a unor minerale apartinand acestora.
In fig.4 este reprezentata grafic compozitia chimica a unor clinopiroxeni din seria (Ca,Mg,Fe)[Si2O6] (tabel 9) in diagrama (sistemul) Wo-En-Fs, folosindu-se proportiile moleculare de participare a acestora (molecular %, egale cu proportiile moleculare ale oxizilor si cu proportiile cationilor, vezi pag. 27).
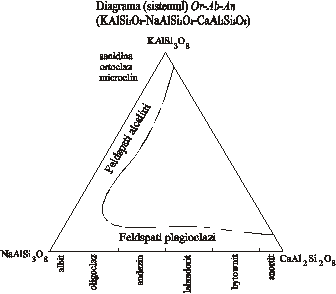
 In fig.5 este reprezentata extinderea seriei izomorfe (K,Na,Ca)[(Si,Al)3O8]
in grupa feldspatilor la temperatura ridicata in sistemul
Or-Ab-An in proportii moleculare ale acestora (egale cu proportiile
cationice). Pe aceasta diagrama se delimiteaza doua serii
izomorfe continue (feldspati alcalini si feldspati plagioclazi)
si un domeniu compozitional in care nu exista minerale omogene
cu chimism intermediar, numit lacuna de
miscibilitate.
In fig.5 este reprezentata extinderea seriei izomorfe (K,Na,Ca)[(Si,Al)3O8]
in grupa feldspatilor la temperatura ridicata in sistemul
Or-Ab-An in proportii moleculare ale acestora (egale cu proportiile
cationice). Pe aceasta diagrama se delimiteaza doua serii
izomorfe continue (feldspati alcalini si feldspati plagioclazi)
si un domeniu compozitional in care nu exista minerale omogene
cu chimism intermediar, numit lacuna de
miscibilitate.

 2. Diagramele de asociatie se construiesc pornind de la
diagramele de chimism, adaugandu-se relatiile de asociere a
mineralelor in natura. Ele pot contine de asemenea si
reprezentarea seriilor izomorfe (solutiilor solide).
2. Diagramele de asociatie se construiesc pornind de la
diagramele de chimism, adaugandu-se relatiile de asociere a
mineralelor in natura. Ele pot contine de asemenea si
reprezentarea seriilor izomorfe (solutiilor solide).
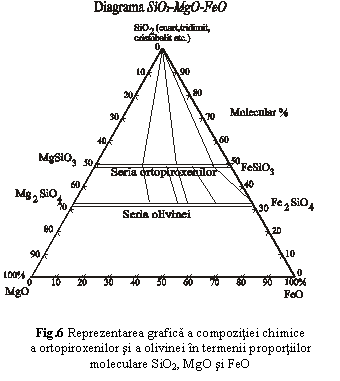
In fig.6 este redat chimismul a doua serii izomorfe care difera prin raportul (Mg+Fe):Si. Prin liniile duble sunt reprezentate mineralele celor doua serii (seria ortopiroxenilor (Mg,Fe)2[Si2O6] si seria olivinei (Mg,Fe)2[SiO4]), iar prin liniile simple sunt unite mineralele care se asociaza in natura. Daca un mineral dintr-o anumita serie este legat prin linii de asociatie cu doua sau mai multe minerale din alte serii, inseamna ca ele se gasesc in natura impreuna (ex.: cuart-ortopiroxen cu ~ 80% FeO, olivina cu 100% FeO). Daca o linie de asociatie uneste un mineral doar cu inca unul, asociatia naturala este formata doar din aceste minerale. De exemplu olivina cu ~ 60% FeO se asociaza cu un ortopiroxen cu ~ 50% FeO, dar nu se mai asociaza si cu cuartul. Similar, cuartul se asociaza cu un ortopiroxen cu ~ 40% FeO, dar nu se mai asociaza si cu minerale din seria olivinei. In concluzie din aceasta diagrama reiese ca asociatia cuart-ortopiroxen-olivina nu este posibila decat daca olivina contine 100% FeO (fayalit), celelalte minerale din seria olivinei asociindu-se exclusiv cu ortopiroxeni.
In fig.7 este reprezentata grafic compozitia chimica a carbonatilor comuni (tabel 10). Cationii care participa sunt Ca, Mg, Fe si Mn. Intrucat reprezentarea grafica a chimismului intr-o diagrama cuaternara (cu patru componenti) ar fi complicat de interpretat, se foloseste o diagrama ternara, in care se introduce un component complex, format din suma a doi componenti simpli: FeO+MnO. Se pot reprezenta astfel prin aceeasi linie dubla extinderea seriilor izomorfe dolomit-ankerit si dolomit-kutnahorit sau ale seriilor magnezit-siderit si magnezit-rodocrozit. Domeniul restrans conturat in jurul calcitului reprezinta extinderea foarte redusa a solutiei solide dintre calcit si termeni ai seriei magnezit-siderit-rodocrozit.
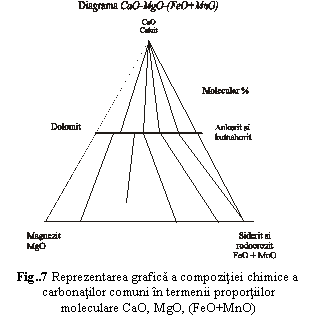
Tabel 10Compozitia chimica a mineralelor reprezentate in fig.7 |
||
Calcit |
CaCO |
100% CaO |
|
Magnezit |
MgCO |
100% MgO |
|
Siderit |
FeCO |
100% FeO |
|
Rodocrozit |
MnCO |
100% MnO |
|
Dolomit |
CaMgCO |
50% CaO; |
|
50% MgO |
||
|
Ankerit |
CaFeCO |
50% CaO; |
|
50% FeO |
||
|
Kutnahorit |
CaMnCO |
50% CaO; |
|
50% MnO |
||
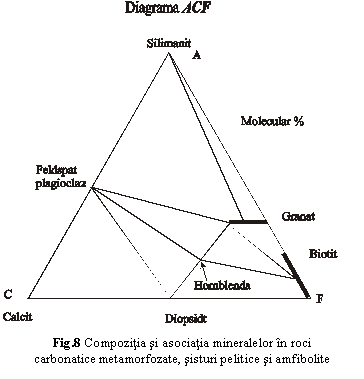
In fig.8 este reprezentata compozitia si asociatia mineralelor din unele roci metamorfice intr-o diagrama mai complexa care grupeaza in fiecare dintre cei trei componenti mai multi oxizi: A=Al2O3+Fe2O3-(Na2O+K2O); C=CaO; F=MgO+MnO+FeO. Liniile mai groase reprezinta serii izomorfe (seria granatilor, seria biotitului), iar liniile mai subtiri unesc mineralele asociate din aceste roci.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |